
Sociedad
Boletín Oficial
ANMAT suspendió las actividades de un laboratorio por anestésicos contaminados
01/09/2025 | El organismo detectó partículas y posible contaminación microbiológica en soluciones utilizadas en pacientes hospitalizados. Es el segundo establecimiento clausurado en menos de una semana.

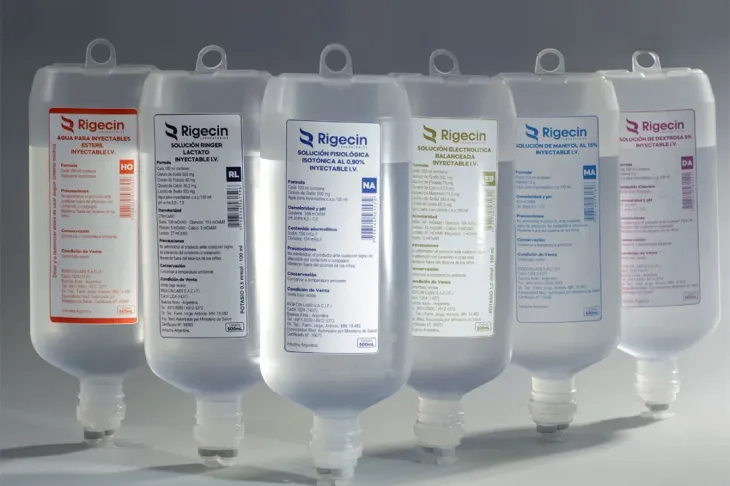
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) inhibió de manera preventiva las actividades productivas del laboratorio Rigecin Labs, tras detectar anestésicos contaminados y otras irregularidades en la fabricación de productos destinados a pacientes de alta vulnerabilidad.
La medida fue publicada este lunes en el Boletín Oficial a través de la Disposición 6202/2025 y representa la segunda clausura de este tipo en apenas cuatro días. La semana pasada ya se había suspendido a la firma P. L. Rivero por fallas en ampollas y sueros.
Productos contaminados y riesgo sanitario
Según informó la ANMAT, la Solución Electrolítica Balanceada Rigecin (500 ml) presentaba “partículas en suspensión y presunta contaminación microbiológica”. El hallazgo fue categorizado como de nivel crítico y de alta prioridad, debido al riesgo que representa para la salud de los pacientes hospitalizados.
Las inspecciones realizadas entre el 6 y el 13 de junio en el establecimiento detectaron incumplimientos graves de las Buenas Prácticas de Fabricación y Control (BPFyC). Pese al plan de acción presentado por la compañía, una nueva verificación del Instituto Nacional de Medicamentos (INAME) confirmó que persistían deficiencias críticas y medidas correctivas insuficientes.
Prohibiciones y retiro de lotes
Además de la suspensión de las actividades productivas, la ANMAT prohibió el uso, comercialización y distribución en todo el país de:
*Solución Electrolítica Balanceada Rigecin (citrato de sodio)
*Solución Molar de Bicarbonato de Sodio Inyectable Rigecin
La disposición también ordena el retiro inmediato del mercado de los lotes EB0440, EB0444, EB0405, EB0455 y EB0438 de la solución electrolítica, y del lote BI0091 de la solución molar de bicarbonato de sodio inyectable.













